Перейти к:
Оценка прямого и опосредованного бактерицидного эффекта газоразрядной низкотемпературной плазмы на бактерии in vitro
https://doi.org/10.47470/dez002
EDN: DNQKPJ
Аннотация
Введение. Применение потока газоразрядной низкотемпературной плазмы атмосферного давления, часто называемого холодной атмосферной плазменной струёй (ХАПС), представляет собой уникальный инструмент для решения актуальных задач биомедицины. ХАПС содержит большое число радикалов и молекул в возбуждённом состоянии, среди которых главную роль играют активные формы кислорода и азота (АФКА), а также включает в себя электроны и световое излучение. Генерируемые плазменной струёй АФКА вступают в реакцию с мембраной клеток и попадают во внутриклеточное пространство. Их активность может приводить к перекисному окислению липидов, повреждению ДНК, денатурации белков, нарушению клеточного метаболизма, что и индуцирует окислительный стресс у клеток.
Материал и методы. В данной работе оценивалась бактерицидная активность локального воздействия ХАПС в отношении репрезентативных штаммов грамположительных и грамотрицательных бактерий. Использовали следующие монокультуры бактерий: грамотрицательные — Escherichia coli и Pseudomonas fluorescens, грамположительные — Bacillus megaterium и Mycobacterium sp. Использовали методы световой микроскопии и оценку выживаемости бактерий по изменению площади подавления роста. Для анализа радикального состава плазменного луча применяли спектрофотометрию.
Результаты. Установлены оптимальные параметры воздействия, обеспечивающие эффективную инактивацию тест-культур микроорганизмов. Через 3 и 24 ч после завершения эксперимента зона подавления бактериального роста у грамотрицательных бактерий была намного больше, чем у грамположительных. При этом область подавления роста у Mycobacterium sp. оказалась наименьшей. Со временем эффект увеличения площади подавления роста после обработки усиливался для всех типов бактерий. Высевы обработанной плазмой биомассы и анализ активности роста бактерий показали, что после обработки бульон-сусло агар становится непригодной для роста бактерий.
Заключение. Результаты подтверждают перспективность локального применения ХАПС как безопасного и эффективного физического метода антимикробной обработки в контексте задач дезинфекции и эпидемиологии.
Вклад авторов:
Абрашитов Г.Н. — сбор и обработка материала, статистическая обработка данных, написание текста, редактирование, ответственность за целостность всех частей статьи;
Манченко Д.М. — концепция и дизайн исследования, ответственность за целостность всех частей статьи;
Леонтьева М.Р. — концепция и дизайн исследования, утверждение окончательного варианта статьи, ответственность за целостность всех частей статьи;
Якунин В.Г. — концепция и дизайн исследования, сбор и обработка материала;
Тимошенко В.Ю. — концепция и дизайн исследования, утверждение окончательного варианта статьи.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Поступила 07.07.2025 / Принята к печати: 20.08.2025 / Опубликована: 10.09.2025
Для цитирования:
Абрашитов Г.Н., Манченко Д.М., Леонтьева М.Р., Якунин В.Г., Тимошенко В.Ю. Оценка прямого и опосредованного бактерицидного эффекта газоразрядной низкотемпературной плазмы на бактерии in vitro. Дезинфектология. 2025;1(1):39-46. https://doi.org/10.47470/dez002. EDN: DNQKPJ
For citation:
Abrashitov G.N., Manchenko D.M., Leontieva M.R., Yakunin V.G., Timoshenko V.Yu. Evaluation of the Direct and Indirect Bactericidal Effect of Low-Temperature Gas-Discharge Plasma on Bacteria In Vitro. Disinfectology. 2025;1(1):39-46. (In Russ.) https://doi.org/10.47470/dez002. EDN: DNQKPJ
Введение
Технология получения холодной атмосферной плазмы в биологических исследованиях появилась более 30 лет назад. При этом сразу были обнаружены её несомненные преимущества и полезные свойства для применения на биологических объектах [1]. Среди наиболее ярких эффектов отмечены ускорение регенерации при действии на повреждённые участки кожи и более глубокие раны, очистка поверхностей от микробного загрязнения и уничтожение раковых клеток. Особенно привлекательной для практического применения является способность этой субстанции оказывать дезинфицирующее действие. Механизм уничтожения бактерий плазмой, основанный на сочетании химических и физических воздействий, весьма сложен и до сих пор не изучен до конца. УФ-излучение, генерируемое во время обработки ХАПС, индуцирует димеризацию тимина и цитозина, что нарушает репликацию бактериальной ДНК и тем самым препятствует размножению бактерий [2]. АФКА могут вызвать сильное окислительное повреждение бактериальных клеток, что приводит к развитию окислительного стресса и в итоге к гибели микроорганизмов [3]. Сообщалось, что АФК, генерируемые ХАПС, могут индуцировать окисление липидов клеточной мембраны E. coli с образованием малонового диальдегида (МДА), который способен необратимо повреждать ДНК и белки, образуя ковалентные соединения [4]. ХАПС имеет уникальное свойство: высокую бактерицидную эффективность при относительно низкой температуре (близкой к комнатной), что исключает тепловое повреждение субстратов. В связи с этим перспективой применения ХАПС, имеющей особое значение для микробиологической практики, является её потенциал для прецизионной локальной очистки. Способность плазменных струй (плазменных «перьев») воздействовать точечно с высоким пространственным разрешением открывает уникальные возможности для селективной инактивации контаминантов в культурах: возможность обработки отдельных участков агара или жидкой культуры для уничтожения нежелательных бактерий без существенного влияния на соседние целевые микроорганизмы или клетки; обработка сложных поверхностей и биоплёнок; обеспечение бережного воздействия на чувствительные субстраты. Несмотря на впечатляющую антимикробную эффективность ХАПС, продемонстрированную в многочисленных исследованиях, её биобезопасность при локальном применении изучена недостаточно, особенно в контексте работы с разнообразными бактериальными системами. Таким образом, целью настоящего исследования является комплексная оценка биобезопасности газоразрядной низкотемпературной плазмы при её использовании для локальной инактивации модельных бактерий — представителей различных таксономических и физиологических групп.
Материал и методы
В работе были использованы следующие монокультуры прокариотических микроорганизмов из коллекции культур кафедры микробиологии биологического факультета МГУ: грамотрицательные — Escherichia coli и Pseudomonas fluorescens, грамположительные — Bacillus megaterium и Mycobacterium sp.
Культуры микроорганизмов выращивали в чашках Петри на плотных средах: бульон-сусло агар (БСА) и БТН-агар. Использовали глубинный и поверхностный посевы. Посев культур и их дальнейшую культивацию осуществляли в соответствии со стандартной методикой по работе с культурами прокариотов, описанной в практических руководствах по микробиологии [5, 6]. Чашку Петри с глубинным посевом культур или отдельными колониями микроорганизмов помещали под струю плазмы, предварительно разметив чашку на отдельные зоны и указав маркером точку попадания луча. Время экспозиции ХАПС на бактерии составляло 5 и 10 мин.
Оценивали диаметр зоны просветления (зона подавления роста бактерий) аналогично методике выявления чувствительности микроорганизмов к антибиотикам [6]. Эксперимент проводили в четырёх повторностях.
Из клеток обработанной колонии готовили препараты для световой микроскопии [6]. Для выявления изменений использовали постоянные фиксированные препараты, окрашенные фуксином, после чего образцы исследовали под световым микроскопом ЛОМО Микмед-5 2М 1500 (ЛОМО) с масляной иммерсией при увеличении 1000.
Проводили анализ жизнеспособности обработанных культур путём высева биомассы клеток из облучённых колоний на чистые чашки Петри с питательной средой: отмечали наличие или отсутствие бактериального роста через 24 ч. Также был проведён анализ площади просветления (гибели микроорганизмов). Площадь подавления роста после облучения была рассчитана с помощью программы ImageJ (Fiji) [7].
Для изучения распространения эффекта обработки холодной плазмой в плотной питательной среде и, следовательно, возможности роста различных бактерий на обработанных участках использовали два методических подхода. Первый — высев тест культур на обработанный участок питательной среды в чашке Петри. Второй — высев бактерий методом штриха по направлению к обработанному плазмой участку питательной среды. В первом случае оценивали наличие роста в обработанной области или его отсутствие. Во втором случае отмечали направление бактериального роста либо по направлению к обработанной области либо от неё. В каждом случае эффект проверяли не менее чем в трёх повторностях. Воздействие ХАПС осуществлялось компактным генератором холодной плазмы (плазмотроном), использующим низкочастотный (30 кГц) газовый разряд с плазмообразующим газом гелием со скоростью потока 3 л/мин при полной потребляемой мощности установки порядка 10 Вт. Диаметр плазменного сопла, в области которого выполняли воздействие, составлял ≈ 5–10 мм, что позволило проводить локальную обработку посевов и колоний бактерий.
Статистическую обработку данных осуществляли с помощью программного обеспечения Statistica v. 10.0 (StatSoft Inc., США), построение графиков и диаграмм — в пакете GraphPad Prism v. 10.2.1.395 (GraphPad Prism Software, LLC). Графики анализировали с помощью one-way ANOVA с поправкой Брауна – Форсайта и Уэлша и апостериорным тестом Данна. Значимые отличия считали достоверными при уровне p < 0,05.
Результаты
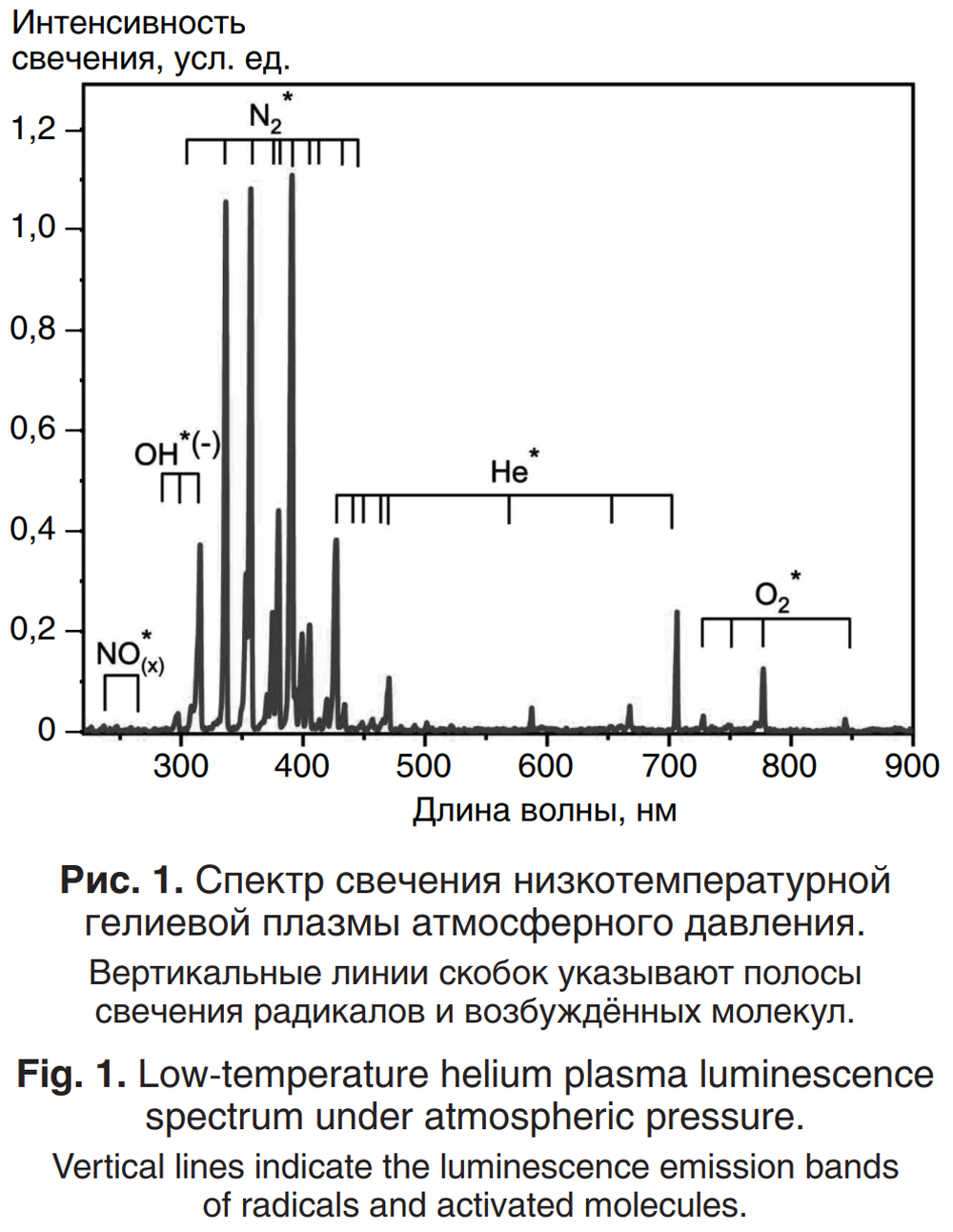
В процессе плазменной обработки бактерий анализировали спектр свечения струи ХАПС, который содержал как линии эмиссии возбуждённых состояний атомов гелия (He•), так и возбуждённых молекул кислорода (О2 •) и азота (N2•), радикалов NO• и OH• (рис. 1).
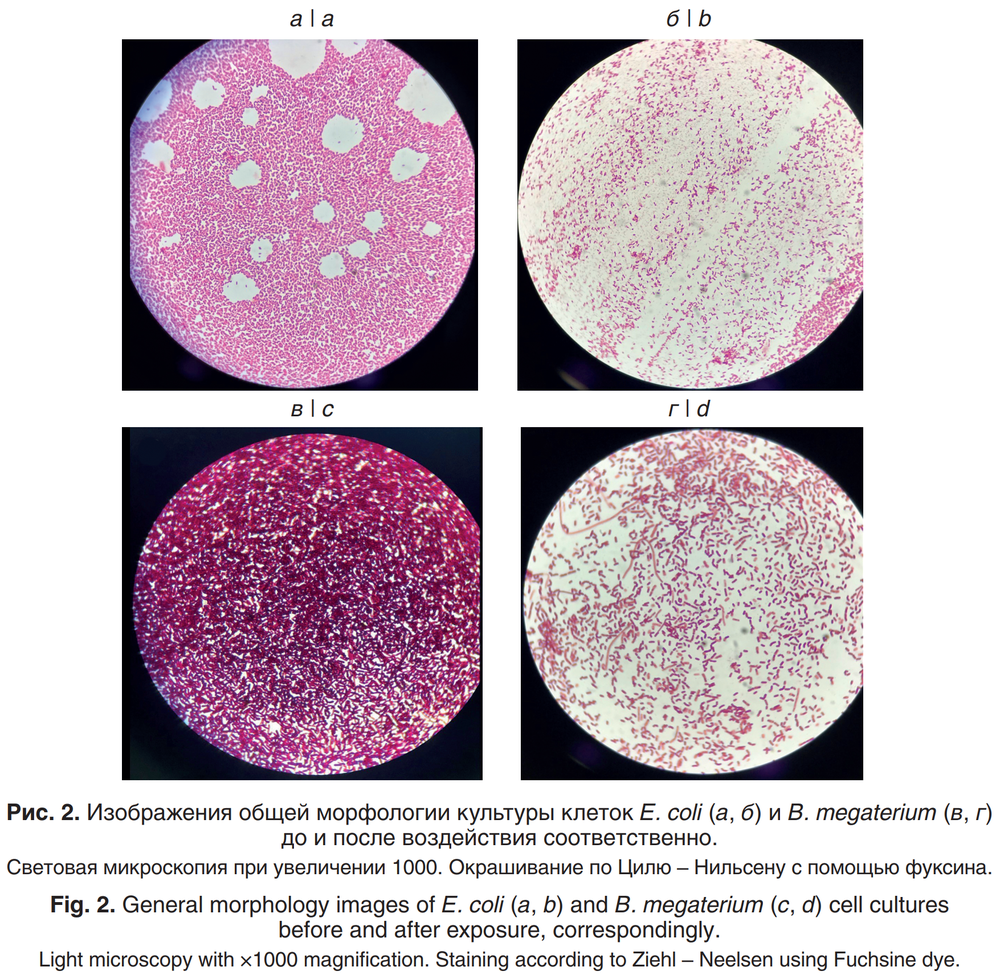
Анализ внешнего вида колоний, а также общей морфологии методом световой микроскопии позволил выявить снижение численности живых клеток, потерю нормальной структуры колоний и иссушение среды. Степень воздействия луча холодной плазмы оценивали по общему виду колоний и окрашенным мазкам микроорганизмов, взятых с обработанных колоний. Результаты световой микроскопии позволили оценить разницу в количестве живых клеток, оставшихся после обработки. Внешний вид колоний, выращенных на питательной среде и облучённых плазмой, — не самый надёжный признак пагубного эффекта, однако уже через 5 мин обработки были отмечены потеря колониями изначальной формы, изреживание бактериальных биоплёнок и иссушение среды. Опыт проводили в четырёх повторениях для каждого вида бактерий.
Анализ проб, взятых для приготовления окрашенных мазков из данных колоний, показал, что общее количество клеток во взятом образце колонии различается в контроле (n = 4) и опыте (n = 4 для каждого вида микроорганизмов) на логарифмический порядок. Появились также клетки с более бледной окраской. Предположительно, эти клетки погибли или утратили целостность, из-за чего фуксин хуже связывался с их мембранными структурами (рис. 2). Однако для точного анализа необходимы более чувствительные методы микроскопии.
При изучении эффекта воздействия холодной плазмы на глубинные посевы культур были выявлены выраженные отличия в чувствительности грамположительных и грамотрицательных бактерий к обработке плазмой. Через 3 и 24 ч после завершения эксперимента зона подавления бактериального роста у грамотрицательных бактерий была намного больше, чем у грамположительных (рис. 3). Поскольку самым важным отличием между этими видами прокариотов является строение клеточной стенки, объяснение дифференцированности данного эффекта состоит в том, насколько по-разному клеточные стенки этих видов взаимодействуют с плазмой.
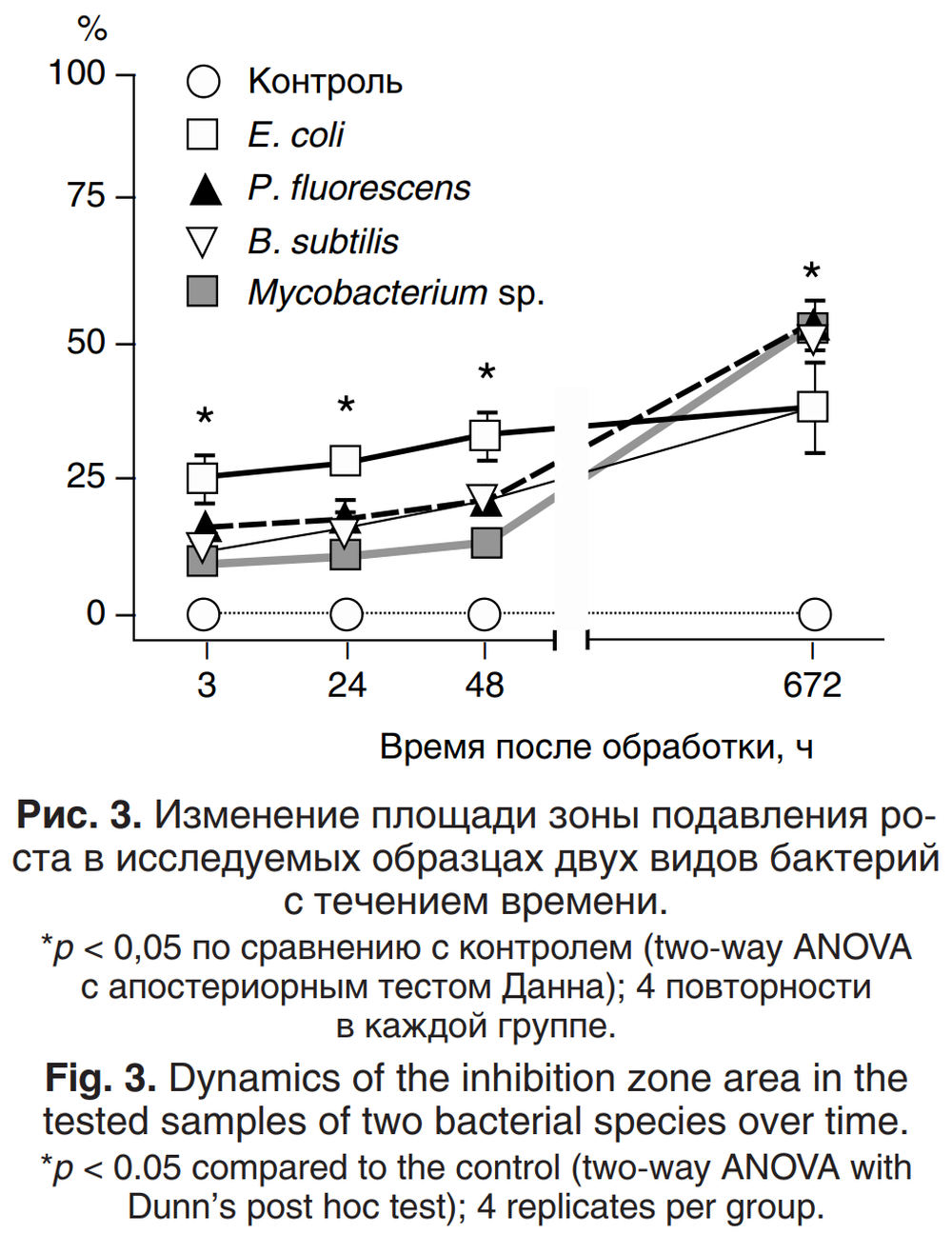
Подтверждение этому можно увидеть при анализе воздействия ХАПС на глубинные посевы: область подавления роста у Mycobacterium sp. через 3 и 24 ч была наименьшей из всех. При анализе воздействия ХАПС на глубинные посевы бактериальных культур было отмечено, что со временем данный эффект усиливался для всех типов бактерий (рис. 3). Это может быть объяснено динамической генерацией и амплификацией реактивных частиц, возникающих из источника плазмы, но впоследствии модифицируемых за счёт взаимодействия с биологическим веществом (т. е. мембранными липидами, полисахаридами или белками). Таким образом, возможны окисление и разрушение питательных веществ, присутствующих в среде, а это приводит к ингибированию дальнейшего роста культур на чашках.
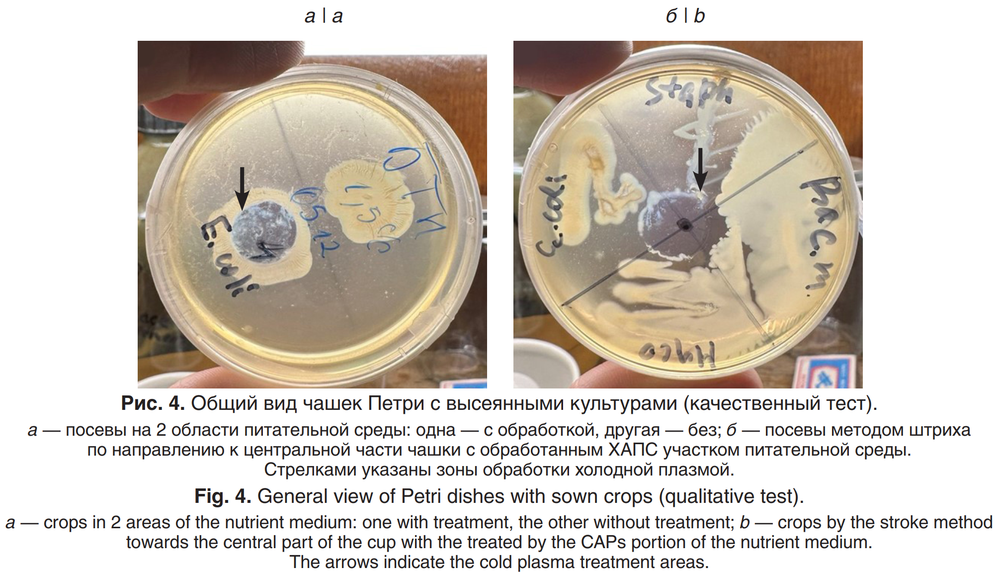
В другом эксперименте с оценкой чувствительности различных типов прокариотов к обработанной среде было установлено, что после 10-минутной обработки питательной среды БСА с последующим высевом на обработанные участки биомассы бактерий почти во всех случаях через 24 ч не наблюдали образование колоний (рис. 4, а). Лишь один вид бактерий — Mycobacterium sp. — оказался более толерантным к обработанной среде и формировал колонии как в области обработанного агара, так и в контрольной части чашки Петри. Кроме того, результаты экспериментов с определением активности роста бактерий в область обработанной среды методом штриха показали, что все бактерии (грамположительные, грамотрицательные и кислотоустойчивые) не формировали фронта нарастания в обработанную область агара через 24 ч после посева (рис. 4, б). Эти данные убедительно доказывают, что обработанная плазмой питательная среда претерпевает физико-химические изменения, которые не позволяют микроорганизмам использовать её для роста.
Обсуждение
Ключевые компоненты мембран почти всех бактерий — липополисахариды, фосфолипиды, пептидогликаны и мембранные белки [8]. Стенка клеток грамположительных бактерий толще (20–80 нм), обладает большей жёсткостью, чем стенка клеток грамотрицательных (1,5–10,0 нм), и состоит из толстого слоя муреина (пептидогликана) со встроенными тейхоевыми и липотейхоевыми кислотами. У грамотрицательных бактерий клеточная стенка содержит тонкий слой пептидогликана и имеет наружную мембрану [9]. Поверхность грамотрицательных клеток шероховатая и неровная из-за наличия содержащей липополисахариды внешней мембраны, которая может быть более чувствительной к электростатическому разрушению [10]. Отдельно стоит отметить, что в нашем исследовании были протестированы бактерии с тремя различными типами строения клеточной стенки. Mycobacterium sp. относятся к грамположительным, однако имеют отличительную особенность — тонкий слой муреина в клеточной стенке и дополнительный внешний слой из миколовых кислот и свободных липидов [11]. Именно наличие этих структур позволяет отнести Mycobacterium sp. к так называемому кислотоустойчивому типу (т. е. устойчивому к действию различных сильных окислителей, в том числе свободных радикалов). Это делает микобактерии самым устойчивым типом среди использованных нами культур прокариотов.
В литературе чётко описаны механизмы химических реакций, которые происходят с белками, пептидными молекулами и углеводами, содержащимися в БСА. Обработка ХАПС, включающей большое количество заряженных частиц и радикалов, приводит к разрушению углеродных связей в данных молекулах, потере третичной структуры белков и уменьшению размеров самих молекул за счёт их деградации под действием плазмы [12]. Таким образом, холодная плазма может быть эффективным инструментом в обработке различных поверхностей с целью дезинфекции. Этот эффект обеспечивается нарушением оптимальных условий для роста бактерий, а не только их непосредственным уничтожением. Модификация условий среды роста бактерий после обработки холодной плазмой приводит к тому, что питательные вещества и соединения становятся менее доступными (например, в результате потери нативной структуры) для микроорганизмов. Поэтому прямая обработка сред может служить новым и эффективным дополнением к классическим методам борьбы с устойчивыми штаммами микроорганизмов. Это открывает новые возможности для успешной и безопасной локальной дезинфекции, что особенно актуально в условиях появления всё большего количества устойчивых штаммов прокариотических микроорганизмов.
Заключение
Установлено, что при определённых параметрах плазменной обработки можно добиться значимого эффекта селективной эрадикации микроорганизмов, что подтверждает биобезопасность данного метода. Воздействие холодной плазмы на прокариотические организмы проявляется в разрушении клеточных покровов и подавлении роста.
Грамположительные и грамотрицательные бактерии имеют разную устойчивость к плазменному воздействию, что, по-видимому, не связано напрямую со строением их клеточных покровов. Предположительно, данный эффект обусловлен различной чувствительностью к количеству и набору питательных веществ в обработанной плазмой среде. Это указывает на перспективность использования ХАПС при направленной модификации биологических сред, а также для безопасной и эффективной дезинфекции.
Список литературы
1. Kong M.G., Kroesen G.M.W., Morfill G. et al. Plasma medicine: an introductory review. New Journal of Physics. 2009; 11(11): 115012-1/35. 115012. doi: 10.1088/1367-2630/11/11/115012
2. Setlow P., Li L. Photochemistry and photobiology of the spore photoproduct: a 50‐year journey. Photochem. Photobiol. 2015; 91(6): 1263–90. DOI: https://doi.org/10.1111/php.12506
3. Misra N.N., Yadav B., Roopesh M.S., Jo C. Cold plasma for effective fungal and mycotoxin control in foods: mechanisms, inactivation effects, and applications. Compr. Rev. Food Sci. Food Saf. 2019; 18(1): 106–20. DOI: https://doi.org/10.1111/1541-4337.12398
4. Joshi S.G., Cooper M., Yost A., Paff M., Ercan U.K., Fridman G., et al. Nonthermal dielectric-barrier discharge plasma-induced inactivation involves oxidative DNA damage and membrane lipid peroxidation in Escherichia coli. Antimicrob. Agents Chemother. 2011; 55(3): 1053–62. DOI: https://doi.org/10.1128/aac.01002-10
5. Нетрусов А.И., Котова И.Б. Микробиология: теория и практика. М.; 2018.
6. Егорова М.А., Леонтьева М.Р., Малахова Д.В., Сорокина Е.В., Цавкелова Е.А. Учебное пособие по практической биологии. Раздел «Микробиология». М.; 2022.
7. Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., et al. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 2012; 9(7): 676–82. DOI: https://doi.org/10.1038/nmeth.2019
8. Batt S.M., Abrahams K.A., Besra G.S. Top five unanswered questions in bacterial cell wall research. Cell Surf. 2024; 11: 100122. DOI: https://doi.org/10.1016/j.tcsw.2024.100122
9. Huang K.C., Mukhopadhyay R., Wen B., Gitai Z., Wingreen N.S. Cell shape and cell-wall organization in Gram-negative bacteria. Proc. Natl Acad. Sci. USA. 2008; 105(49): 19282–19287. DOI: https://doi.org/10.1073/pnas.0805309105
10. Braný D., Dvorská D., Halašová E., Škovierová H. Cold atmospheric plasma: A powerful tool for modern medicine. Int. J. Mol. Sci. 2020; 21(8): 2932. DOI: https://doi.org/10.3390/ijms21082932
11. Lee C., Subhadra B., Choi H.G., Suh H.W., Uhm H.S., Kim H.J. Inactivation of mycobacteria by radicals from non-thermal plasma jet. J. Microbiol. Biotechnol. 2019; 29(9): 1401–11. DOI: https://doi.org/10.4014/jmb.1904.04060
12. Kazemi A., Nicol M.J., Bilén S.G., Kirimanjeswara G.S., Knecht S.D. Cold atmospheric plasma medicine: Applications, challenges, and opportunities for predictive control. Plasma. 2024; 7(1): 233–57. DOI: https://doi.org/10.3390/plasma7010014
Об авторах
Глеб Николаевич АбрашитовРоссия
Студент-магистр каф. физиологии человека и животных биологического факультета ФГБОУ ВО МГУ им. М.В. Ломоносова, Москва. Россия
e-mail: gleb58a@mail.ru
Дарья Михайловна Манченко
Россия
Канд. биол. наук, доцент каф. физиологии человека и животных биологического факультета ФГБОУ ВО МГУ им. М.В. Ломоносова, Москва, Россия
e-mail: dashishka@mail.ru
Мария Романовна Леонтьева
Россия
Канд. биол. наук, доцент каф. микробиологии биологического факультета ФГБОУ ВО МГУ им. М.В. Ломоносова, Москва, Россия
e-mail: x_blade@inbox.ru
Валерий Георгиевич Якунин
Россия
Канд. физ.-мат. наук, с. н. с. каф. физики полупроводников и криоэлектроники физического факультета ФГБОУ ВО МГУ им. М.В. Ломоносова, Москва, Россия
e-mail: yvg51@bk.ru
Виктор Юрьевич Тимошенко
Россия
Д-р физ.-мат. наук, профессор каф. физики низких температур и сверхпроводимости физического факультета МГУ им. М.В. Ломоносова, Москва, Россия
e-mail: victor_timoshenk@mail.ru
Рецензия
Для цитирования:
Абрашитов Г.Н., Манченко Д.М., Леонтьева М.Р., Якунин В.Г., Тимошенко В.Ю. Оценка прямого и опосредованного бактерицидного эффекта газоразрядной низкотемпературной плазмы на бактерии in vitro. Дезинфектология. 2025;1(1):39-46. https://doi.org/10.47470/dez002. EDN: DNQKPJ
For citation:
Abrashitov G.N., Manchenko D.M., Leontieva M.R., Yakunin V.G., Timoshenko V.Yu. Evaluation of the Direct and Indirect Bactericidal Effect of Low-Temperature Gas-Discharge Plasma on Bacteria In Vitro. Disinfectology. 2025;1(1):39-46. (In Russ.) https://doi.org/10.47470/dez002. EDN: DNQKPJ








