Перейти к:
Возможность использования крыс линии Вистар как модельного объекта при исследовании влияния воспаления и непредсказуемого стресса на тревожность и циклы «сон — бодрствование»
https://doi.org/10.47470/dez003
EDN: MAEDFW
Аннотация
Введение. Метод «двойного удара» представляет собой модель воздействия на организм двух повреждающих факторов на разных этапах онтогенеза. Известно, что стресс может играть роль триггера в развитии болезней центральной нервной системы, действуя на фоне изменения уровня про- и противовоспалительных факторов вследствие раннего воспаления.
Материалы и методы. В экспериментах на крысах Вистар были использованы в качестве повреждающих факторов неонатальное воспаление, вызванное введением липополисахарида на 7-й и 9-й постнатальные дни (ПНД) в дозе 50 мкг/кг, и повторяющееся стрессогенное воздействие в подростковом возрасте. Уровень тревожности оценивали дважды: до стрессирующего воздействия с помощью О-образного лабиринта (на 31-й ПНД) и после стресса с помощью приподнятого крестообразного лабиринта (на 40-й ПНД). С 36-го по 39-й ПНД часть животных подвергалась субхроническому непредсказуемому стрессу. При достижении возраста 3 месяцев самцам проводили операцию вживления нихромовых электродов и последующую круглосуточную регистрацию полисомнограммы.
Результаты. Раннее постнатальное воспаление не влияет на уровень тревожности и архитектуру сна у крыс, в то время как непредсказуемое субхроническое стрессирующее воздействие в предпубертатный период приводит к развитию гиперактивности и нарушает продолжительность циклов «сон — бодрствование».
Обсуждение. Лабораторные крысы (в частности крысы линии Вистар) подвергались длительной доместикации и содержались в контролируемых условиях в течение многих поколений, что привело к снижению их адаптивного потенциала. Таким образом, лабораторные крысы, подобно современному человеку, существуют в искусственно стабилизированной среде, что делает их более чувствительными к внешним воздействиям по сравнению с дикими сородичами.
Заключение. Несмотря на изначально высокую биологическую пластичность вида Rattus norvegicus, лабораторные линии крыс являются адекватной моделью для изучения различных процессов, актуальных для человеческой популяции.
Этическое утверждение. Работа одобрена комиссией по биоэтике ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова» (протокол № 194-ж от 26.12.2024), проведено в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS N 123), директивой Европейского парламента и Совета Европейского союза.
Благодарность. Коллектив авторов сердечно благодарит Владимира Матвеевича Ковальзона за помощь в организации экспериментов и бесценные советы по обработке данных.
Источник финансирования. Исследование выполнено в рамках государственного задания МГУ имени М.В. Ломоносова.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Поступила 07.07.2025 / Принята к печати: 20.08.2025 / Опубликована: 10.09.2025
Ключевые слова
Для цитирования:
Кульпина А.А., Герасимов А.А., Манченко Д.М., Глазова Н.Ю., Левицкая Н.Г. Возможность использования крыс линии Вистар как модельного объекта при исследовании влияния воспаления и непредсказуемого стресса на тревожность и циклы «сон — бодрствование». Дезинфектология. 2025;1(1):31-38. https://doi.org/10.47470/dez003. EDN: MAEDFW
For citation:
Kulpina A.A., Gerasimov A.A., Manchenko D.M., Glazova N.Yu., Levitskaya N.G. The Possibility of Using Wistar Rats as a Model Organism in Studying the Inflammation and Non-Predictable Stress on Anxiety and Sleep-Wake Cycles. Disinfectology. 2025;1(1):31-38. (In Russ.) https://doi.org/10.47470/dez003. EDN: MAEDFW
Введение
Стрессовые реакции представляют собой комплексный защитный механизм, направленный на поддержание гомеостаза при кратковременных экстремальных воздействиях. Однако при хроническом стрессе эти адаптивные механизмы приобретают деструктивный характер, приводя к многочисленным нарушениям здоровья. Спектр нарушений, возникающих вследствие стресса, очень широк: от нейродегенеративных процессов до развития психических расстройств, таких как депрессия и тревожные состояния. Наиболее яркими и заметными признаками развивающейся болезни часто становятся беспокойство, когнитивные расстройства и нарушения сна [1, 2]. Ранняя диагностика позволяет своевременно начать терапию и не допустить резкого прогрессирования болезни. Особую роль в восприимчивости организма к стрессирующим воздействиям играют инфекционные болезни и воспалительные процессы. Воспаление, перенесённое в раннем возрасте, способно существенно повлиять на функционирование гипоталамо-гипофизарно-надпочечниковой оси, иммунной и нервной систем, что приводит к долговременной перестройке защитных механизмов и изменяет устойчивость организма к последующим стрессовым воздействиям, в частности, к хроническому стрессу [3].
Подбор адекватной модели и протокола тестирования поведения на животных необходим для детального изучения механизмов провокации нарушений в работе ЦНС и разработки путей их коррекции. Модель «двойного удара» используется при исследовании причин и механизмов возникновения болезней ЦНС [4]. Эта модель включает последовательное воздействие двух неблагоприятных факторов — в раннем постнатальном периоде и в подростковом или взрослом возрасте. Такие комплексные модели позволяют изучать взаимодействие факторов, приближенных к реальным условиям жизни человека, и способствуют углублённому пониманию механизмов развития стресс-ассоциированных патологий и других физиологических нарушений. В последние годы данная модель активно используется для изучения патогенеза депрессивных и тревожных расстройств.
В научной литературе отмечено, что дикие серые крысы (Rattus norvegicus) и лабораторные крысы линии Вистар, несмотря на принадлежность к одному виду, демонстрируют значительные различия в устойчивости к внешним воздействиям. Дикие особи обладают повышенной резистентностью к неблагоприятным факторам среды, что обусловлено естественным отбором, обеспечивающим сохранение наиболее адаптивных генотипов. А лабораторные крысы, на протяжении множества поколений содержащиеся в контролируемых условиях, подвергались искусственному отбору, не направленному на поддержание адаптивных функций организма, что и привело к снижению их общей устойчивости к стрессорам. Тем не менее, несмотря на выраженные признаки доместикации, лабораторные крысы сохранили способность, хотя и ослабленную, противостоять негативным воздействиям в процессе онтогенеза.
Целью данной работы было исследование влияния «двойного удара» на уровень тревожности и продолжительность циклов «сон – бодрствование» у крыс линии Вистар. В нашем исследовании в качестве «первого удара» использовались инъекции липополисахарида (ЛПС) (бактериального эндотоксина, активирующего реакции врождённой системы иммунитета) в неонатальном периоде, а в качестве «второго удара» — субхроническое непредсказуемое стрессирующее воздействие.
Материалы и методы
Работу проводили на детёнышах белых крыс линии Вистар обоего пола. Всего в экспериментах было использовано 83 крысы (40 самок и 43 самца). Все манипуляции с животными были выполнены согласно принципам гуманности, изложенным в директиве Совета Европейского Союза (86/609/ЕЭС), и ГОСТ 33216–2014 «Руководство по содержанию и уходу за лабораторными животными». Работа одобрена комиссией по биоэтике МГУ (протокол № 194-ж от 26.12.2024).
После рождения детёныши крыс были разделены на две группы. На 7-й и 9-й постнатальные дни (ПНД) животным опытной группы внутрибрюшинно вводили ЛПС в дозе 50 мкг/кг, контрольной группе — воду для инъекций. На 31-й ПНД проводили оценку уровня тревожности в тесте «О-образный лабиринт» [5]. С 34-го по 39-й ПНД половину животных из каждой группы подвергали субхроническому непредсказуемому стрессу (СНС). Применяли следующие стрессирующие факторы: принудительное плавание, иммобилизация, яркое освещение, мокрый подстил, скученность и питьевая депривация. Стрессирование проводили по методике, описанной М. Papp и соавт. [6].
Таким образом, в дальнейших экспериментах использовали 4 группы крыс: подвергавшиеся воспалению и стрессирующему воздействию (ЛПС + СНС); получавшие ЛПС, но не подвергавшиеся СНС (ЛПС); перенёсшие стресс, но не получавшие ЛПС неонатально (СНС); контрольные (Контроль).
Через 1 сутки после окончания СНС (40-й ПНД) оценивали уровень тревожности животных в приподнятом крестообразном лабиринте (ПКЛ) в условиях контрастного освещения рукавов лабиринта по методике, описанной в нашей предыдущей работе [7].
При достижении животными возраста трёх месяцев в каждой группе случайным образом были выбраны четыре самца, которым субдурально вживляли нихромовые электроды. Электроды располагали по два над лобной и теменной корой и один референтный электрод в ростральной части лобной кости.
Через пять дней после операции начинали непрерывную круглосуточную регистрацию полисомнограммы (ПСГ), включающей два канала ЭЭГ и запись механограммы с помощью акселерометра. Каждое животное было подсоединено гибким кабелем к усилителю биопотенциалов (конструкции А.А. Трощенко), снабжённому трёхмерным акселерометром. Такая конструкция позволяет регистрировать ПСГ, не ограничивая свободу перемещений животного, и даёт возможность усилителю биопотенциалов со встроенным акселерометром свободно колебаться в трёх плоскостях, реагируя даже на небольшие движения крысы. Визуальный полуавтоматический анализ полученных данных ПСГ по 20-секундным эпохам проводили с помощью специальной программы, созданной на базе EDF-браузера с открытым кодом [8].
При статистической обработке данных использовали программу Statistica 10.0 (StatSoft Inc, 2013). Для проверки нормальности распределения применяли критерий Шапиро – Уилка. Если анализ выборок показывал, что распределение соответствует критериям нормального, для дальнейшей обработки использовали дисперсионный анализ (ANOVA). При отличном от нормального распределении выборок использовали непараметрический критерий Манна – Уитни. Для сравнения связанных выборок (при оценке циклов «сон – бодрствование») применяли парный t-тест, поскольку распределение в данном случае было нормальным (по критерию Шапиро – Уилка). Различия считали статистически значимыми при p < 0,05.
Результаты
Статистическая обработка результатов исследования поведения животных в тестах «О-образный лабиринт» и ПКЛ с помощью двухфакторного ANOVA не выявила достоверного влияния фактора ПОЛ (F < 0,14; p > 0,71), а также взаимодействия факторов ПОЛ/Группа (F < 0,78; p > 0,38), что позволило представить данные по всей выборке крыс.
При оценке уровня тревожности животных в тесте «О-образный лабиринт» не было выявлено значимых различий между опытной и контрольной группами (p > 0,15; критерий Манна – Уитни; рис. 1). Таким образом, неонатальное воспаление, вызванное введением ЛПС, не влияло на тревожность крыс на 31-й ПНД. Перед началом стрессирующего воздействия уровень тревожности у всех животных был одинаковым.
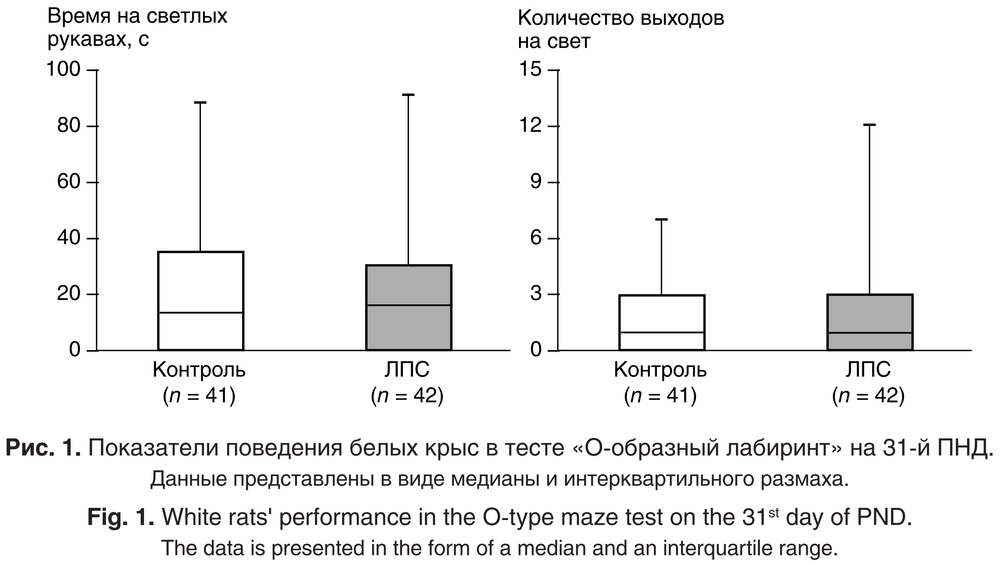
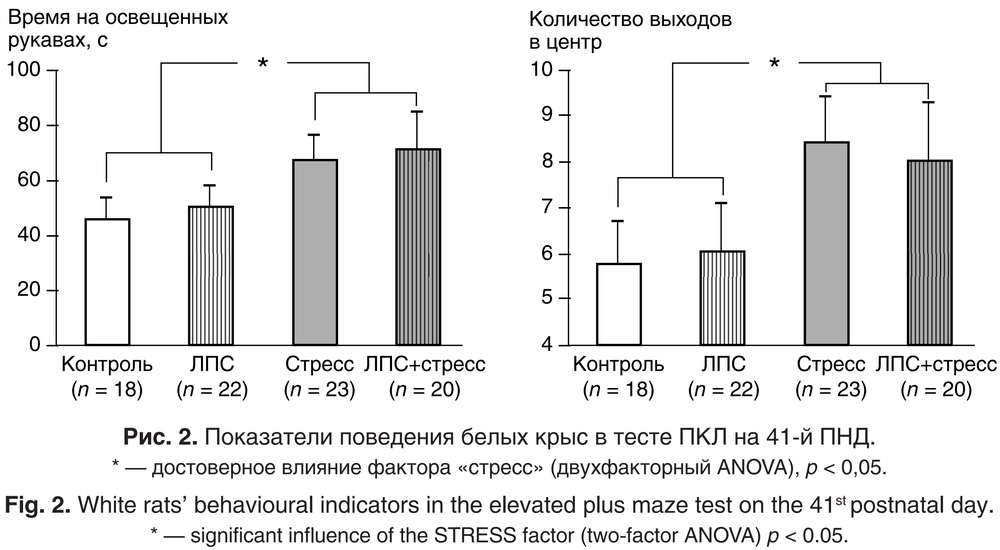
Через 1 сутки после окончания СНС исследовали уровень тревожности крыс в тесте ПКЛ. Было выявлено достоверное влияние фактора СНС (F(1, 73) = 4,08; p = 0,047), однако не установлено значимого влияния фактора ЛПС (F(1, 73) = 0,40; p = 0,52) и взаимодействия факторов ЛПС/СНС (F(1, 73) = 0,07; p = 0,79). Все животные, подвергавшиеся стрессирующему воздействию (группы СНС и ЛПС+ СНС), больше времени проводили на свету и чаще выходили в центр лабиринта по сравнению с нестрессированными крысами (группы ЛПС и Контроль) (рис. 2). Возможно, субхронический стресс привёл к развитию у животных гиперактивности и повышенной импульсивности [9].
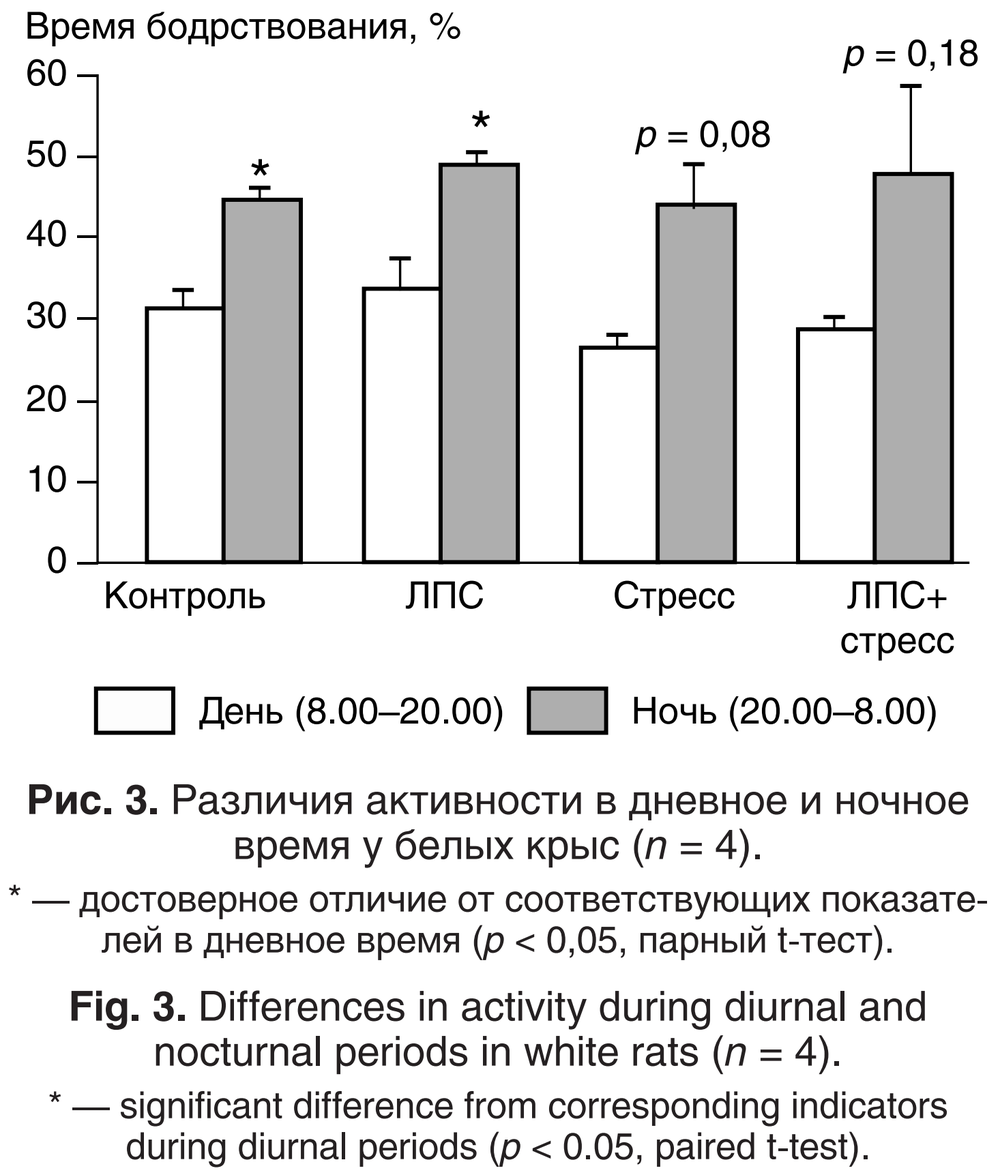
Анализ циклов «сон – бодрствование» выявил достоверные отличия в продолжительности дневного и ночного бодрствования между группами Контроль и ЛПС. У крыс, подвергавшихся СНС, различия в продолжительности бодрствования днём и ночью проявлялись только на уровне тенденции (р < 0,1; рис. 3).
Обсуждение
Показано, что раннее постнатальное воспаление, вызванное введением ЛПС, не оказывает отставленного влияния на тревожность крыс, а также продолжительность и структуру циклов «сон – бодрствование». В то же время непредсказуемое стрессирующее воздействие в предпубертатном периоде приводит к развитию гиперактивности и вызывает небольшие, но долговременные нарушения в циклах «сон – бодрствование». Схожие, но более выраженные реакции на подобные воздействия наблюдаются и у человека [10].
Несмотря на то, что серая крыса (Rattus norvegicus) в естественных условиях демонстрирует высокую адаптированность к изменениям окружающей среды и устойчивость к стрессовым воздействиям, лабораторные линии крыс (в частности, линия Вистар) представляют релевантную модель для экстраполяции экспериментальных данных на человека [11]. Это обусловлено длительной доместикацией лабораторных крыс и содержанием их в контролируемых условиях вне естественного отбора, что привело к снижению адаптивного потенциала. В результате лабораторные крысы, подобно современному человеку, существуют в искусственно стабилизированной среде, что делает их более чувствительными к внешним воздействиям по сравнению с дикими сородичами.
Таким образом, несмотря на изначально высокую биологическую пластичность вида Rattus norvegicus, лабораторные линии крыс являются адекватной моделью для изучения физиологических, нейробиологических и патологических процессов, актуальных для человеческой популяции. Данный подход подтверждается высокой степенью гомологии ключевых молекулярных и системных механизмов регуляции у грызунов и приматов [12].
В нашем исследовании особое внимание уделено анализу циклов «сон – бодрствование», поскольку нарушения сна являются одним из ключевых маркёров стресс-индуцированных расстройств [1]. Известно, что хронический стресс приводит к характерным изменениям архитектуры сна, в том числе к сокращению продолжительности медленноволнового сна и увеличению числа пробуждений [10, 13].
Заключение
Лабораторные линии крыс являются адекватной моделью для изучения различных процессов, актуальных для человеческой популяции. Наши результаты показали наличие нарушений продолжительности сна у животных, перенёсших стрессирующее воздействие, что также подтверждает возможность использования крыс линии Вистар для моделирования стресс-индуцированных расстройств у человека.
Список литературы
1. Mrdalj J., Pallesen S., Milde A.M., Jellestad F.K., Murison R., Ursin R., et al. Early and later life stress alter brain activity and sleep in rats. PLoS One. 2013; 8(7): e69923. DOI: https://doi.org/10.1371/journal.pone.0069923
2. Rohan Walker F., Nilsson M., Jones K. Acute and chronic stress-induced disturbances of microglial plasticity, phenotype and function. Curr. Drug Targets. 2013; 14(11): 1262–76. DOI: https://doi.org/10.2174/13894501113149990208
3. Walker A.K., Nakamura T., Byrne R.J., Naicker S., Tynan R.J., Hunter M., et al. Neonatal lipopolysaccharide and adult stress exposure predisposes rats to anxiety-like behaviour and blunted corticosterone responses: implications for the double-hit hypothesis. Psychoneuroendocrinology. 2009; 34(10): 1515–25. DOI: https://doi.org/10.1016/j.psyneuen.2009.05.010
4. Mao M., Li S., Zong M., Qiu L., Yang J., Xia J., et al. Two-hit model of postintensive care syndrome induced by lipopolysaccharide challenge and subsequent chronic unpredictable stress in mice. Int. Immunopharmacol. 2019; 70: 446–58. DOI: https://doi.org/10.1016/j.intimp.2019.03.012
5. Манченко Д.М., Глазова Н.Ю., Себенцова Е.А., Андреева Л.А., Долотов О.В., Каменский А.А. и др. Влияние фрагмента АКТГ15-18 и его аналога АКТГ15-18PRO-GLY-PRO на последствия острого стрессогенного воздействия. Журнал высшей нервной деятельности им. И.П. Павлова. 2022; 72(4): 561–75. DOI: https://doi.org/10.31857/S0044467722040074EDN: https://elibrary.ru/qfpboo
6. Papp M., Willner P. Models of affective illness: chronic mild stress in the rat. Curr. Protoc. 2023; 3(3): e712. DOI: https://doi.org/10.1002/cpz1.712
7. Glazova N.Y., Manchenko D.M., Volodina M.A., Merchieva S.A., Andreeva L.A., Kudrin V.S., et al. Semax, synthetic ACTH(4-10) analogue, attenuates behavioural and neurochemical alterations following early-life fluvoxamine exposure in white rats. Neuropeptides. 2021; 86: 102114. DOI: https://doi.org/10.1016/j.npep.2020.102114
8. Манолов А.И., Ковальзон В.М., Украинцева Ю.В., Моисеенко Л.С., Дорохов В.Б. Зависимость точности автоматического выделения состояний сна и бодрствования у мышей от спектральных характеристик электроэнцефалограммы. Журнал высшей нервной деятельности им. И.П. Павлова. 2015; 65(5): 635. DOI: https://doi.org/10.7868/S0044467715040097EDN: https://elibrary.ru/uveuaj
9. Costa-Nunes J., Zubareva O., Araújo-Correia M., Valença A., Schroeter C.A., Pawluski J.L., et al. Altered emotionality, hippocampus-dependent performance and expression of NMDA receptor subunit mRNAs in chronically stressed mice. Stress. 2014; 17(1): 108–16. DOI: https://doi.org/10.3109/10253890.2013.872619
10. Radwan B., Jansen G., Chaudhury D. Sleep-wake dynamics pre- and post-exposure to chronic social stress. iScience. 2021; 24(10): 103204. DOI: https://doi.org/10.1016/j.isci.2021.103204
11. Cooper T.K., Meyerholz D.K., Beck A.P., Delaney M.A., Piersigilli A., Southard T.L., et al. Research-relevant conditions and pathology of laboratory mice, rats, gerbils, guinea pigs, hamsters, naked mole rats, and rabbits. ILAR J. 2021; 62(1-2): 77–132. DOI: https://doi.org/10.1093/ilar/ilab022
12. Mouse Genome Sequencing Consortium. Initial sequencing and comparative analysis of the mouse genome. Nature. 2002; 420(6915): 520–62. DOI: https://doi.org/10.1038/nature01262
13. Cheeta S., Ruigt G., van Proosdij J., Willner P. Changes in sleep architecture following chronic mild stress. Biol. Psychiatry. 1997; 41(4): 419–27. DOI: https://doi.org/10.1016/s0006-3223(96)00058-3
Об авторах
Арина Андреевна КульпинаРоссия
Бакалавр лаб. общей физиологии и регуляторных пептидов кафедры физиологии человека и животных Биологического факультета ФГБОУ ВО МГУ им. М.В. Ломоносова, Москва, Россия
e-mail: arinakulpina@yandex.ru
Андрей Алексеевич Герасимов
Россия
Магистр лаб. общей физиологии и регуляторных пептидов кафедры физиологии человека и животных Биологического факультета ФГБОУ ВО МГУ им. М.В. Ломоносова, Москва, Россия
e-mail: drewgerasimov@gmail.com
Дарья Михайловна Манченко
Россия
Канд. биол. наук, доцент лаб. общей физиологии и регуляторных пептидов кафедры физиологии человека и животных Биологического факультета ФГБОУ ВО МГУ им. М.В. Ломоносова, Москва, Россия
e-mail: dashishka@mail.ru
Наталия Юрьевна Глазова
Россия
Канд. биол. наук, н. с. лаб. общей физиологии и регуляторных пептидов кафедры физиологии человека и животных Биологического факультета ФГБОУ ВО МГУ Москва, Россия
e-mail: tusy-g@yandex.ru
Наталья Григорьевна Левицкая
Россия
Д-р биол. наук, с. н. с. лаб. общей физиологии и регуляторных пептидов кафедры физиологии человека и животных Биологического факультета ФГБОУ ВО МГУ, Москва, Россия
e-mail: nglevitskaya@gmail.com
Рецензия
Для цитирования:
Кульпина А.А., Герасимов А.А., Манченко Д.М., Глазова Н.Ю., Левицкая Н.Г. Возможность использования крыс линии Вистар как модельного объекта при исследовании влияния воспаления и непредсказуемого стресса на тревожность и циклы «сон — бодрствование». Дезинфектология. 2025;1(1):31-38. https://doi.org/10.47470/dez003. EDN: MAEDFW
For citation:
Kulpina A.A., Gerasimov A.A., Manchenko D.M., Glazova N.Yu., Levitskaya N.G. The Possibility of Using Wistar Rats as a Model Organism in Studying the Inflammation and Non-Predictable Stress on Anxiety and Sleep-Wake Cycles. Disinfectology. 2025;1(1):31-38. (In Russ.) https://doi.org/10.47470/dez003. EDN: MAEDFW








